Liệu pháp đồng hóa cho bệnh loãng xương (Anabolic Therapy for Osteoporosis)
Thursday, 12/08/2021, 07:18 GMT+7
Liệu pháp đồng hóa cho bệnh loãng xương
Kristine E. Ensrud, MD, MPH1,2; John T. Schousboe, MD, PhD3,4
Author Affiliations Article Information
JAMA. 2021;326(4):350-351. doi:10.1001/jama.2021.0233
Lược dịch: BS CKI Lê Hoàng Việt
Chuyên Khoa Nhiễm – Trưởng Khoa Khám bệnh, Bệnh viện Tâm Trí Đồng Tháp
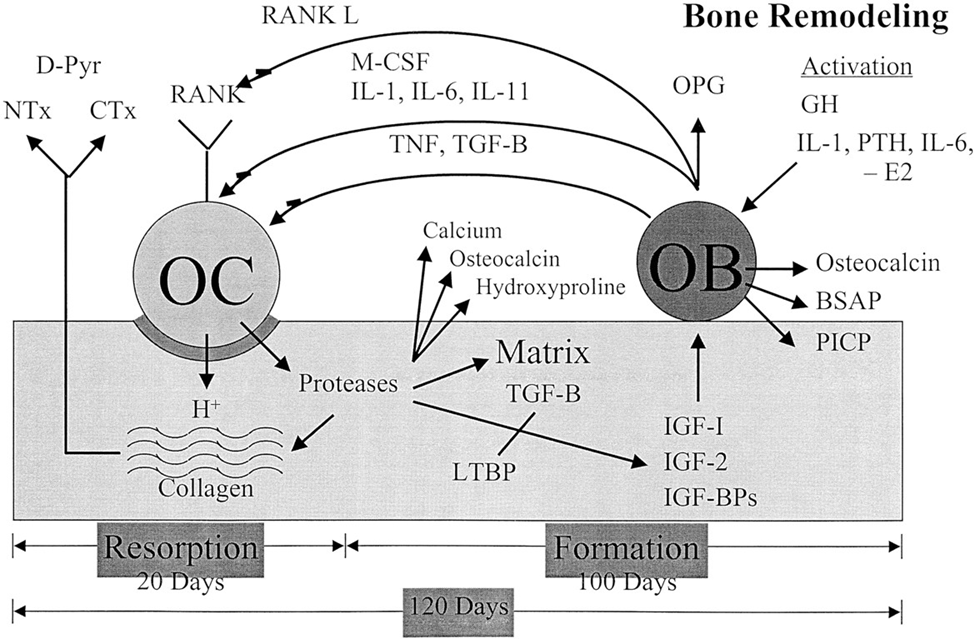
Các loại thuốc được sử dụng để giảm nguy cơ gãy xương liên quan đến loãng xương là những loại thuốc chống biến dạng (ngăn chặn quá trình hủy cốt bào) hoặc liệu pháp đồng hóa (thúc đẩy quá trình hình thành xương mới bằng cách kích hoạt nguyên bào xương). Thuốc chống biến dạng đã được xem xét. Thông tin chi tiết của JAMA này thảo luận về việc sử dụng các loại thuốc đồng hóa, bao gồm teriparatide, abaloparatide và romosozumab.
Về mặt lâm sàng
Thuốc đồng hóa không phải là lựa chọn hàng đầu với bệnh loãng xương vì chi phí đắc, cần phải tiêm dưới da và các lo ngại về an toàn lâu dài. Trong khi bisphosphonates vẫn là lựa chọn đầu tay cho hầu hết bệnh nhân, có một số bằng chứng từ các thử nghiệm ngẫu nhiên, đối tượng là phụ nữ mãn kinh bị loãng xương với nguy cơ gãy xương rất cao cho thấy nguy cơ gãy xương ở nhóm phụ nữ được điều trị bằng thuốc đồng hóa nhiều hơn so với sử dụng bisphosphonates đường uống (eTable trong Phần bổ sung). Do đó, việc sử dụng chất đồng hóa có thể được xem xét ở những bệnh nhân loãng xương với nguy cơ gãy xương cao mà chưa điều trị. Những bệnh nhân bị loãng xương thất bại với các biện pháp chống biến dạng khi vẫn tuân thủ điều trị tốt cũng là đối tượng cho liệu pháp đồng hóa.
Về mặt tổng quát
Gợi ý về việc xem xét sử dụng chất đồng hóa cho bệnh nhân loãng xương có nguy cơ gãy xương rất cao.
Phương pháp này chưa được thử nghiệm trong các thử nghiệm lâm sàng. BMD cho biết mật độ khoáng của xương; PTH, hormone tuyến cận giáp. Teriparatide (dạng tái tổ hợp của hormone tuyến cận giáp [PTH]) và abaloparatide (dạng tương tự tổng hợp của protein liên quan đến PTH [PTHrP]) phát huy tác dụng thông qua liên kết với thụ thể PTH-1. Trong khi việc tiếp xúc liên tục với PTH hoặc PTHrP ở mức cao dẫn đến thúc đẩy quá trình hủy cốt bào, thì việc sử dụng ngắt quãng sẽ kích thích sự hình thành xương sớm hơn và ở mức độ cao hơn so với sự tái hấp thu, dẫn đến tăng mật độ khoáng của xương (BMD).
Điều trị bằng cách tiêm teriparatide hoặc abaloparatide dưới da hàng ngày trong 18 đến 21 tháng ở phụ nữ mãn kinh bị loãng xương với nguy cơ gãy xương rất cao làm giảm gãy xương đốt sống và không phải đốt sống do sự cố (eTable trong Phần bổ sung), nhưng ít thống kê trong giảm nguy cơ gãy xương hông. Chống chỉ định sử dụng teriparatide hoặc abaloparatide bao gồm cường cận giáp nguyên phát hoặc thứ phát, các rối loạn tăng calci huyết khác, tăng calci niệu, sỏi niệu, hoặc tăng nguy cơ mắc bệnh u xương (ví dụ, tiền sử bệnh Paget, bức xạ xương, di căn xương hoặc các khối u ác tính ở xương). Do tăng axit uric huyết thanh liên quan đến điều trị, nên thận trọng khi dùng teriparatide hoặc abaloparatide cho bệnh nhân có tiền sử bệnh gút.
Trước khi dùng cần xác định nồng độ canxi huyết thanh, PTH, albumin, photphas, Creatine và Phosphatase kiềm, canxi và creatine nước tiểu 24h và 25- hydroxyvitamin D. Điều chỉnh tình trạng thiếu vitamin D là cần thiết trước khi bắt đầu điều trị. Vì hạ huyết áp tư thế thoáng qua đã được báo cáo với liều khởi đầu của teriparatide và abaloparatide, nên khi dùng liều đầu tiên bệnh nhân có thể nằm xuống nếu các triệu chứng xảy ra.
Romosozumab là một kháng thể đơn dòng được nhân tính hóa đối với protein sclerostin do tế bào xương tiết ra, một chất ức chế con đường truyền tín hiệu Wnt. Bằng cách ngăn chặn sclerostin, romosozumab kích hoạt con đường này, tăng sự hình thành xương đồng thời làm giảm quá trình hủy cốt bào. Vì vậy, romosozumab được coi là nhân tố tác dụng kép. Romosozumab được chuyên gia khuyên tiêm dưới da mỗi tháng một lần.
Điều trị bằng Romosozumab trong 12 tháng làm giảm nguy cơ gãy xương đốt sống (eTable trong Phần bổ sung). Trong thử nghiệm FRAME đối với romosozumab và giả dược trong 12 tháng (tiếp theo là 12 tháng của denosumab ở cả hai nhóm) ở phụ nữ mãn kinh bị loãng xương, không có sự khác biệt đáng kể về nguy cơ gãy xương không đốt sống ở 24 tháng giữa các nhóm (eTable). Tuy nhiên, trong thử nghiệm ARCH ở phụ nữ sau mãn kinh bị loãng xương và gãy xương dễ gãy (gãy đốt sống phát hiện qua X quang hoặc gãy xương hông gần đây), 12 tháng dùng romosozumab, sau đó là 12 tháng dùng alendronat so với 24 tháng chỉ dùng alendronat đã cho thấy giảm nguy cơ gãy xương ngoài đốt sống bao gồm gãy xương hông lúc 24 tháng ở nhóm được điều trị bằng romosozumab (eTable trong Phần bổ sung).
Trước khi dùng thuốc, cần điều chỉnh về mức bình thường nồng độ creatinine, canxi và 25-hydroxyvitamin D trong huyết thanh. Romosozumab có thể gây hạ calci huyết, đặc biệt ở những bệnh nhân suy thận từ trung bình đến nặng. Lượng canxi nên được tối ưu hóa, và thiếu hụt vitamin D nên được điều chỉnh lại trước khi bắt đầu khởi động romosozumab.
Tác hại tiềm ẩn
Đã có một cảnh báo xấu về việc sử dụng teriparatide hoặc abaloparatide vì sự gia tăng tỷ lệ mắc bệnh u xương phụ thuộc vào liều lượng được quan sát thấy trong các nghiên cứu trên động vật. Tuy nhiên, FDA đã loại bỏ cảnh báo đối với teriparatide vào tháng 11 năm 2020 vì phát hiện này không được xác nhận trong các nghiên cứu giám sát sau khi đưa ra thị trường. Cảnh báo xấu về nguy cơ gia tăng các biến cố bệnh tim mạch (CVD) liên quan đến romosozumab đã được nhắc đến vì có tỷ lệ cao hơn các biến cố tim bất lợi lớn trong năm ở nhóm romosozumab (2.0%) so với alendronate (1.1%) trong nhóm Thử nghiệm ARCH. Bệnh nhân có tiền sử nhồi máu cơ tim hoặc đột quỵ trong năm qua hoặc có nguy cơ mắc bệnh tim mạch cao không nên dùng romosozumab. U xương hàm và gãy xương đùi không điển hình đã được ghi nhận trong hoặc sau khi điều trị bằng romosozumab. Người ta không thể đánh giá khả năng xuất hiện của những tác dụng phụ này khi sử dụng nhiều thuốc này.
Thời gian điều trị
Do nguy cơ gây ung thư (theo lý thuyết) và không chắc chắn về hiệu quả sau 18 tháng điều trị nên tổng thời gian điều trị abaloparatide được giới hạn không quá 2 năm trong suốt cuộc đời. Việc sử dụng teriparatide hơn 2 năm trong suốt cuộc đời chỉ nên được xem xét ở những bệnh nhân vẫn còn hoặc đã trở lại với nguy cơ gãy xương rất cao. Do tác dụng làm xương suy yếu với thời gian điều trị kéo dài hơn 1 năm trong các thử nghiệm=> thời gian điều trị bằng romosozumab được giới hạn trong 1 năm.
Sử dụng các chất chống biến dạng và liệu pháp đồng hóa
Các nghiên cứu ngẫu nhiên về tác dụng của các chất đồng hóa với kết quả gãy xương đã loại trừ những bệnh nhân đã được điều trị gần đây bằng các chất chống biến dạng. Tuy nhiên, trong thực hành lâm sàng, người ta thường gặp những bệnh nhân được kê đơn thuốc đồng hóa có tiền sử sử dụng liệu pháp chống dị ứng kéo dài và được cho gần đây. Hầu hết các nghiên cứu cho thấy một số giảm sút với tăng BMD khi teriparatide3 hoặc romosozumab4 được sử dụng cho những bệnh nhân đã được điều trị trước đó bằng bisphosphonate (đặc biệt là bisphosphonates có thời gian bán hủy xương dài hơn như zoledronate) so với ở những bệnh nhân chưa điều trị. Các bác sĩ nên tránh kê đơn teriparatide hoặc abaloparatide ở những bệnh nhân ngừng điều trị denosumab vì sự suy giảm BMD và tăng tốc độ luân chuyển xương đã được ghi nhận ở những bệnh nhân được chuyển từ denosumab sang teriparatide.
BMD tăng nhanh chóng sau khi ngừng sử dụng bất kỳ tác nhân đồng hóa nào. Điều trị kết hợp với việc sử dụng đồng thời teriparatide và bisphosphonate không làm tăng BMD so với đơn trị liệu. Tuy nhiên, kết hợp teriparatide và denosumab làm tăng BMD hơn là một trong hai. Vì tác dụng trên nguy cơ gãy xương là không chắc chắn, điều trị kết hợp không nên được sử dụng trên lâm sàng mà chỉ nên áp dụng trong nghiên cứu.
Kết luận
Việc sử dụng tối ưu các tác nhân đồng hóa cần được nắm vững bằng cách hiểu rõ về lợi ích, tác hại của chúng, thời gian điều trị được khuyến cáo, việc sử dụng thuốc chống kích ứng trước đó và nhu cầu điều trị chống kích ứng sau khi điều trị bằng thuốc đồng hóa. Lợi ích của liệu pháp đồng hóa trong việc giảm nguy cơ gãy xương có thể thấp hơn ở những bệnh nhân đã được điều trị bằng thuốc chống đau trước đó. Các bác sĩ đầu tiên nên cân nhắc giới thiệu những bệnh nhân chưa từng điều trị với bệnh loãng xương mà có nguy cơ gãy xương rất cao hoặc những bệnh nhân thất bại trong điều trị khi đang điều trị bằng thuốc bisphosphonates nên đến bác sĩ chuyên khoa để xem xét liệu pháp đồng hóa.
Gửi thông tin của đồng nghiệp tới ccrandall@mednet.ucla.edu.
Tài liệu tham khảo
1.
Ensrud KE, Crandall CJ. Bisphosphonates for postmenopausal osteoporosis. JAMA. 2019;322(20):2017-2018. doi:10.1001/jama.2019.15781
ArticlePubMedGoogle ScholarCrossref
2.
Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020;105(3):dgaa048.PubMedGoogle Scholar
3.
Obermayer-Pietsch BM, Marin F, McCloskey EV, et al. Effects of two years of daily teriparatide treatment on BMD in postmenopausal women with severe osteoporosis with and without prior antiresorptive treatment. J Bone Miner Res. 2008;23(10):1591-1600. doi:10.1359/jbmr.080506PubMedGoogle ScholarCrossref
4.
Langdahl BL, Libanati C, Crittenden DB, et al. Romosozumab (sclerostin monoclonal antibody) versus teriparatide in postmenopausal women with osteoporosis transitioning from oral bisphosphonate therapy. Lancet. 2017;390(10102):1585-1594.PubMedGoogle ScholarCrossref
5.
Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study). Lancet. 2015;386(9999):1147-1155.PubMedGoogle ScholarCrossref
6.
Leder BZ, Neer RM, Wyland JJ, et al. Effects of teriparatide treatment and discontinuation in postmenopausal women and eugonadal men with osteoporosis. J Clin Endocrinol Metab. 2009;94(8):2915-2921. doi:10.1210/jc.2008-2630PubMedGoogle ScholarCrossref
7.
McClung MR, Brown JP, Diez-Perez A, et al. Effects of 24 months of treatment with romosozumab followed by 12 months of denosumab or placebo in postmenopausal women with low bone mineral density. J Bone Miner Res. 2018;33(8):1397-1406. doi:10.1002/jbmr.3452PubMedGoogle ScholarCrossref
8.
Cosman F, Eriksen EF, Recknor C, et al. Effects of intravenous zoledronic acid plus subcutaneous teriparatide [rhPTH(1-34)] in postmenopausal osteoporosis. J Bone Miner Res. 2011;26(3):503-511.PubMedGoogle ScholarCrossref
9.
Finkelstein JS, Wyland JJ, Lee H, Neer RM. Effects of teriparatide, alendronate, or both in women with postmenopausal osteoporosis. J Clin Endocrinol Metab. 2010;95(4):1838-1845.PubMedGoogle ScholarCrossref
10.
Tsai JN, Uihlein AV, Lee H, et al. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis. Lancet. 2013;382(9886):50-56.PubMedGoogle ScholarCrossref
Other news :
- PHÒNG NGỪA TÉ NGÃ TRONG BỆNH (31/07/2023)
- PHÒNG NGỪA TÉ NGÃ TRONG BỆNH (20/07/2023)
- PHẪU THUẬT THAY KHỚP HÁNG TẠI BỆNH VIỆN TÂM TRÍ HỒNG NGỰ (12/07/2023)
- Những điều cần biết về ung thư tuyến giáp (10/07/2023)
- GẮP THÀNH CÔNG TRƯỜNG HỢP XƯƠNG CÁ GÂY THỦNG MÔN VỊ (08/07/2023)
- CA BỆNH NHỒI MÁU CƠ TIM CẤP ST CHÊNH LÊN ĐƯỢC TIÊU SỢI HUYẾT THÀNH CÔNG (07/07/2023)
- Chụp X-quang có ảnh hưởng đến sức khỏe hay không ? (06/07/2023)
- CẢNH BÁO NGỘ ĐỘC DO LẠM DỤNG THUỐC (29/06/2023)
- SÀNG LỌC NGUY CƠ SANH NON: Đo chiều dài kênh cổ tử cung. (20/06/2023)
- KHÁM SÀNG LỌC TRƯỚC KHI MANG THAI (10/06/2023)

 Vietnamese
Vietnamese English
English
